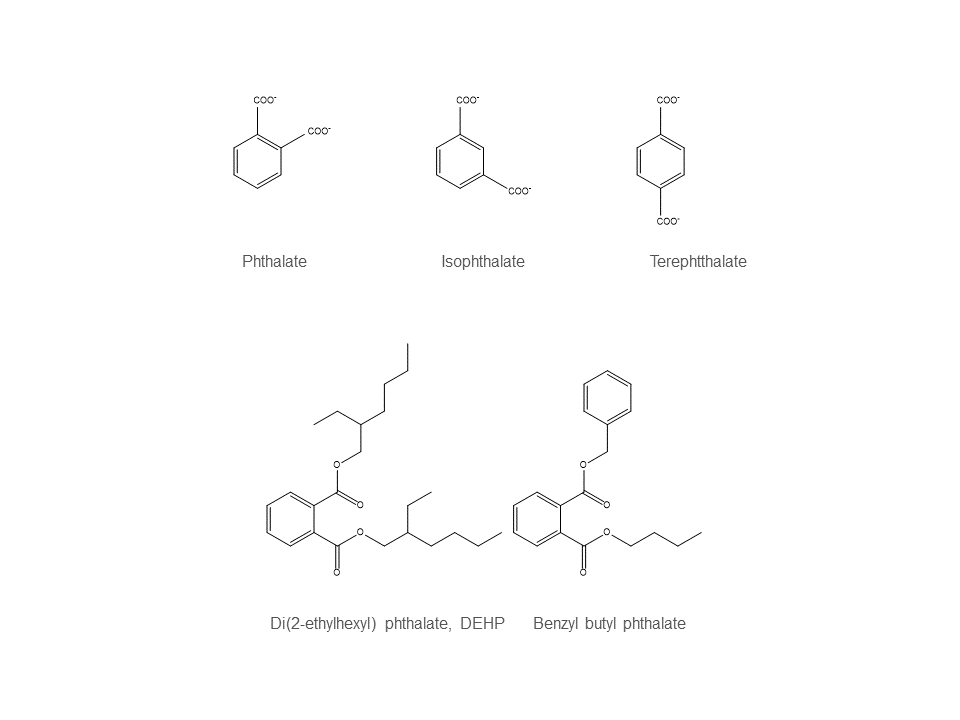
苯二甲酸的微生物降解
苯二甲酸酯常被用做为塑料工业中塑化剂和其他各种化工产品的添加剂,最终经由工业废水,填埋场渗漏液,塑料容器等进入与人接触的生活环境。苯二甲酸酯是致癌致畸致突变的三致有毒化学物,其中邻苯二甲酸二丁酯(DBP),邻苯二甲酸二甲酯(DMP),和邻苯二甲酸二(2-乙基己基)酯(DEHP)仍被列入美国环保署的有毒化学物清单。
自然环境中存在很多微生物均可降解苯二甲酸,已研究过的降解菌有革兰氏阴性的 Burkholderia,Comamonas,Delftia,Pseudomonas,和革兰氏阳性的Arthrobacter,Terrabacter,Mycobacterium,Rhodococcus。苯二甲酸的厌氧降解研究较少,有研究者从厌氧污泥中分离得到对苯二甲酸降解菌Pelotomaculum terephthalicum JT和Pelotomaculum isophthalicum JI,这两个菌株与产甲烷菌Methanospirillum hungatei混培能降解对苯二甲酸产生乙酸和甲烷,但单独培养是无降解能力。
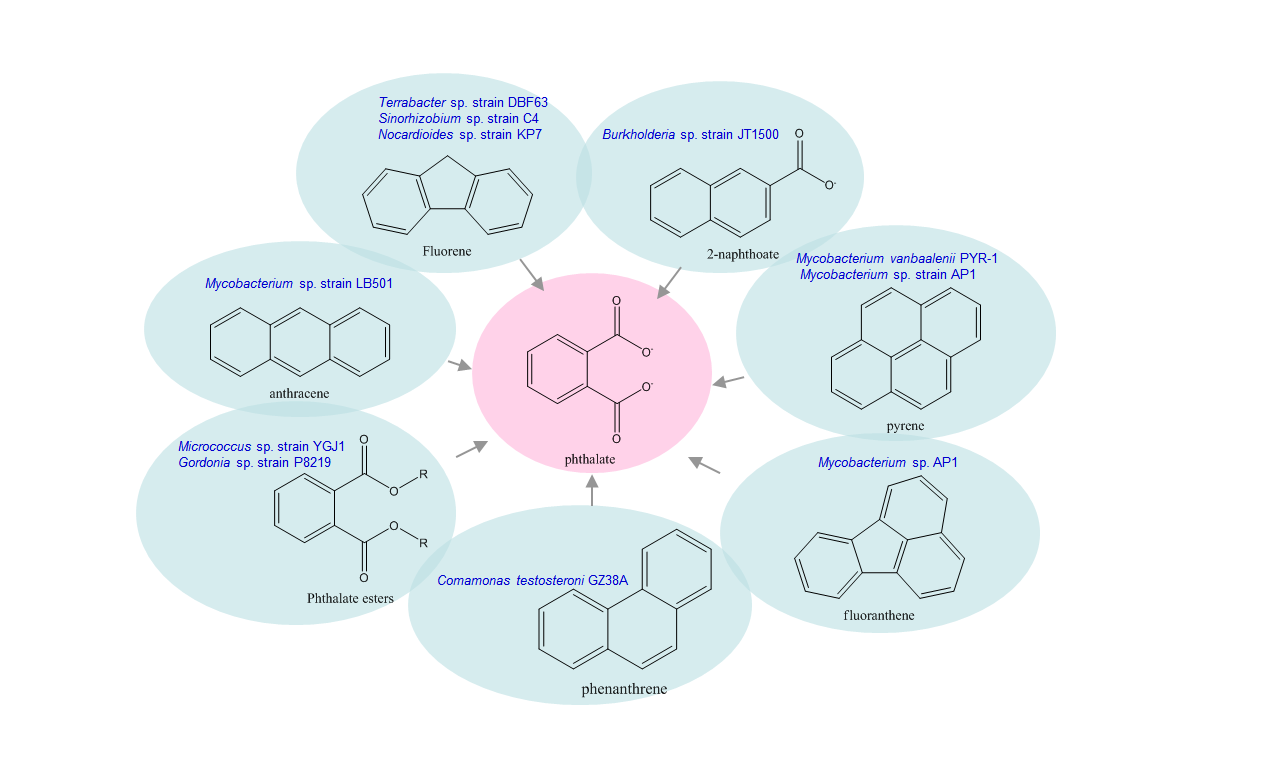
不同的微生物可将多环芳烃和苯二甲酸酯先分解成苯二甲酸;苯二甲酸是共同中间代谢产物。
苯二甲酸酯通常先被微生物产生的酯酶降解成单酯和游离的苯二甲酸;后者有经由原儿茶酸途径进入中心代谢途径。苯二甲酸降解途径在很多微生物中又是多环芳烃降解途径的一部分。革兰氏阴性和革兰氏阳性菌通过两个不同生化途径降解邻苯二甲酸。革兰氏阴性和革兰氏阳性细菌先分别将苯二甲酸转化成4,5-二羟邻苯二甲酸或3,4-二羟邻苯二甲酸,并最终合并到原儿茶酸降解途径。在革兰氏阴性菌中,邻苯二甲酸酯被由邻苯二甲酸双加氧酶转化为顺式-4,5-二氢-4,5-二羟邻苯二甲酸。该双加氧酶是一双组分酶,由邻苯二甲酸双加氧酶还原酶和邻苯二甲酸双加氧酶组成。顺式-4,5-二氢-4,5-二羟邻苯二甲酸再由二羟邻苯二甲酸脱氢酶转化成4,5-二羟邻苯二甲酸;最后由4,5-二羟邻苯二甲酸脱羧酶将4,5-二羟邻苯二甲酸转化形成原儿茶酸。在革兰氏阳性细菌的降解途径中,邻苯二甲酸转化儿茶酸是通过顺式-3,4-二氢-3,4-二羟邻苯二甲酸和3,4-二羟邻苯二甲酸。其中起催化作用双加氧酶,二氢二醇脱氢酶,脱羧酶等和革兰氏阴性菌的酶并无亲缘关系。
邻苯二甲酸好氧微生物降解途径
间苯二甲酸和对苯二甲酸好氧微生物降解途径
苯二甲酸的厌氧降解途径研究很少。一般认为苯二甲酸异构体经过脱羧反应生成苯甲酰辅酶A,然后进入下游途径。
苯二甲酸的厌氧微生物降解途径
苯二甲酸微生物降解的分子遗传学
苯二甲酸降解菌株的分离和多样性
苯二甲酸(包括三种异构体)和苯二甲酸酯被作为塑料添加剂大量地使用于塑料制造业中,因而广泛存在于环境中。但是和多环芳烃相比,单环的苯二甲酸较容易被环境中的微生物所降解。微生物研究者们已分离到很多可降解三种苯二甲酸同分异构体微生物菌种。因此邻苯二甲酸酯降解微生物的研究不仅仅为污染物的生物修复提供微生物和分子基础,而且也为污染物降解途径和降解基因多样性和分子进化提供理论模型。在我们前期研究中, 我们先从河床沉积物中分离到9个不同的细菌菌株。这9个菌株属于丛毛单胞菌,假单胞菌属,不动杆菌属,节杆菌等不同的属,而且表现出有不同的基质谱。这些菌株可使用邻苯二甲酸、间苯二甲酸、或对苯二甲酸作为唯一碳源和能源的增长。
苯二甲酸降解菌株的16S系统发育关系
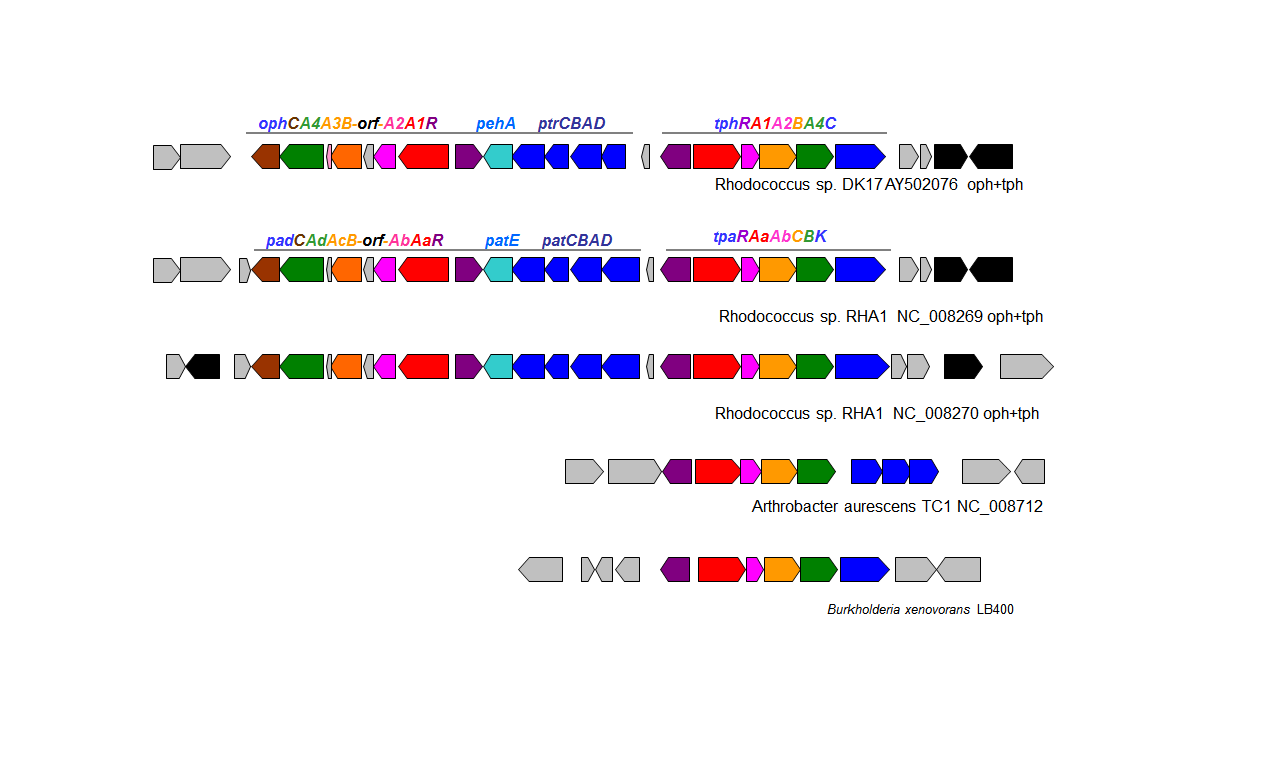
苯二甲酸降解菌降解的基因排列
我们最早对其中一个丛毛单胞菌菌株携带的间苯二甲酸和对苯二甲酸降解基因进行了克隆和测序 。然后我们把研究重点放在寻找出九个来自同一沉积物的菌株携带的邻苯二甲酸酯,间苯二甲酸,对苯二甲酸降解基因的差异。我们先应用PCR和反向PCR 确定睾丸酮丛毛单胞菌菌株和假单胞菌菌株携带的邻苯二甲酸基因oph ,间苯二甲酸基因iph,和对苯二甲酸基因tph。四个睾丸酮丛毛单胞菌菌株中长度为5.5 kb的对苯二甲酸降解操纵子的序列相似性为 94-97%;其中三个菌株长度为5.0 kb的间苯二甲酸降解操纵子的相似性为96-98%。睾丸酮丛毛单胞菌菌株的对苯二甲酸基因tph的排列顺序为tphRCA2A3BA1;而假单胞菌中tph基因顺序是tphRA2A3BA1C,其中唯一的区别是的tphC的位置。我们利用反向PCR还发现了该假单胞菌菌株总长为9452bp的tph操纵子片段的两侧正好有两个序列完全相同的长度为1302bp的转座酶基因。这就表明假单胞菌菌株对苯二甲酸降解代谢操纵子是通过转座元件的水平转移而获得。睾丸酮丛毛单胞菌的oph基因表现出94-99%相似性;另外,其中一个睾丸酮丛毛单胞菌不含ophD基因(可能编码邻苯二甲酸转运蛋白)。假单胞菌菌株oph基因排列(ophRDA1A2BCE)也不同于睾丸酮丛毛单胞菌,而且只有70-80%的相似性。这些数据表明,从同一环境样品中分离到的邻苯二甲酸,间苯二甲酸和对苯二甲酸降解细菌携带的降解基因均具有菌株特异性的。
革兰氏阴性细菌的邻苯二甲酸降解基因排列
革兰氏阳性细菌的邻苯二甲酸降解基因排列
间苯二甲酸和对苯二甲酸降解基因排列
假单胞菌中由转座子携带插入的总长为9452bp的tph操纵子片段
苯二甲酸降解基因在转录水平上的基因表达和诱导
为了研究是否每个邻苯二甲酸异构体特异性诱导相应的降解基因簇,我们利用实时定量RT-PCR扩增目的基因(编码邻苯二甲酸双加氧酶基因ophA2、间苯二甲酸双加氧酶基因iphA2、和对苯二甲酸双加氧酶基因tphA2)和参考基因(16S、23S、gyrB、rpoB)。实时定量RT-PCR分析表明,邻苯二甲酸、间苯二甲酸、和对苯二甲酸可分别特异性地诱导iphA2、ophA2、和tphA2基因。间苯二甲酸则可诱导tphA2基因小幅上调。含有多个苯二甲酸异构体混合基质没有显著影响邻苯二甲酸降解基因的表达。
苯二甲酸降解调控基因的基因敲除和功能验证
根据序列相似性,我们推测出调控蛋白OphR的功能是控制邻苯二甲酸降解基因的表达。为了验证ophR基因的功能,我们利用基因置换的方法巧除了丛毛单胞菌菌株中的ophR基因,而后测定ophA2, iphA2 ,和tphA2基因的表达。 ophR敲除突变菌株ΔophR实时定量RT-PCR分析表明,利用邻苯二甲酸生长的野生型细胞中ophA2的表达水平为利用琥珀酸生长细胞的322倍。相比之下,邻苯二甲酸盐或琥珀酸上生长的ΔophR细胞中ophA2表达水平为生长琥珀酸种野生型细胞的226和115倍。这个结果表明在ΔophR 菌株中基因ophA2为组成型表达。此外,敲除ophR 并没有影响iphA2和tphA2基因的表达,这表明的ophR是特异性地负责控制邻苯二甲酸的降解。
利用同样的基因置换的方法,我们敲除了属于IclR 家族的调控基因iphR,然后利用RT-qPCR 测定突变株RH5ΔiphR中ophA2、iphA2、和tphA2的基因表达。利用邻苯二甲酸酯或琥珀酸盐上生长的ΔiphR细胞中iphA2表达水平为利用琥珀酸生长的野生型细胞的1095倍和428倍。这个结果表明ΔiphR菌株的iphA2基因为组成型表达;iphR基因编码间苯二甲酸降解的负调控基因。另外,敲除iphR不影响ophA2 ,但是略微影响tphA2基因表达。生长于琥珀酸的ΔiphR突变的tphA2基因表达为野生型的2.8倍,这表明 iphR以某种方式参与了对苯二甲酸降解的基因调控。
苯二甲酸降解调控基因的基因敲除
参考文献
Ruyang Han. 2008. Phthalate degradation: Gene organization, regulation and detection. Ph.D. Thesis. Rutgers University.